翻译2:2019-nCoV与靶向HR1结构域融合抑制剂的融合机制研究
发布时间: 2020-10-13 访问次数: 227
与严重急性呼吸综合征(SARS)冠状病毒类似,2019 nCoV属于B系β-冠状病毒,具有利用人血管紧张素转换酶2(ACE2)作为受体感染人类细胞的能力。3 SARS冠状病毒(S)蛋白S2亚基在介导病毒与宿主细胞融合和进入宿主细胞中起关键作用,其中七烷重复序列1(HR1)和七烷重复序列2(HR2)可以相互作用形成六个螺旋束(6-HB),从而使病毒和细胞膜接近融合。以S-HR1为靶点,我们以前设计并开发了几种有效的抗SARS-CoV(如SARS-HR2P)4和中东呼吸综合征(MERS-HR2P)CoV(如MERS-HR2P)5,但2019-nCoV是否也具有与SARS-CoV和MERS-CoV相似的融合和进入机制,如果是,是否也不清楚2019-nCoV S-HR1也可以作为2019-nCoV融合/进入抑制剂开发的重要目标。
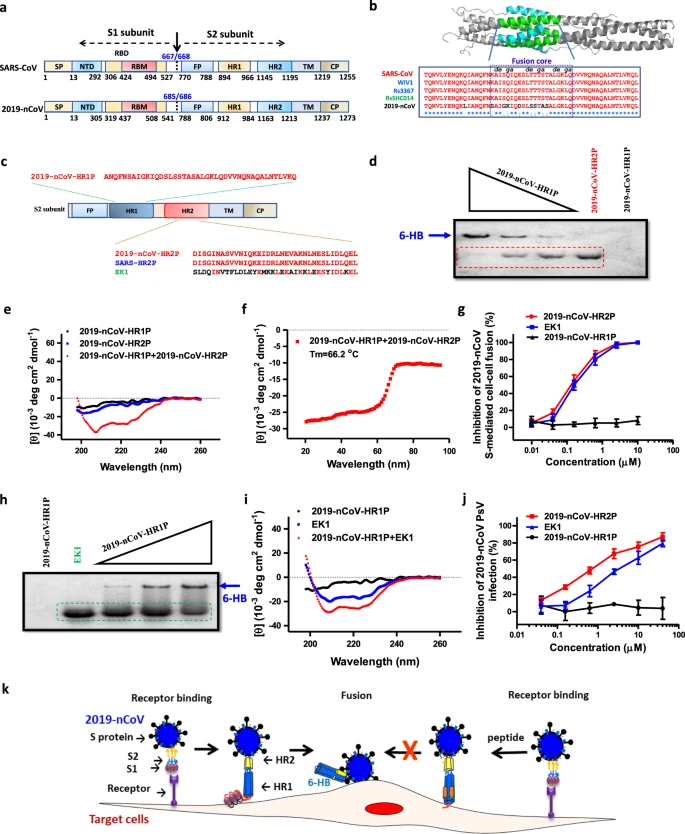
研究结果首次证实了2019 nCoV HR1和HR2区域能够相互作用形成6-HB,并表明2019-nCoV-HR2P可能会抑制2019 nCoV与靶细胞融合并进入靶细胞,正如我们之前对SARS-CoV、MERS-CoV和其他人类CoV所展示的一样。4,5,8证实了这一假设,我们在此开发了一种2019-nCoV S介导的细胞-细胞融合试验。4,5,8使用该分析,我们证明2019-nCoV-HR2P表现出强大的融合抑制活性,半最大抑制浓度(IC50)为0.18µM(图1g),表明2019-nCoV HR1区域可以作为理想的目标位置。另一方面,2019-nCoV-HR1P在高达40μM的浓度下没有表现出明显的抑制作用,这与其他冠状病毒HR1衍生肽(如SARS-HR1P和MERS-HR1P)一致。
我们之前报道过各种冠状病毒中的HR1区域是一个保守的靶位点,基于这个证据,我们设计了一种泛冠状病毒融合抑制剂,表示为EK1.8,与2019-nCoV-HR2P相比,EK1表现出显著的序列变异,但有趣的是,EK1也可以以类似的方式结合2019-nCoV-HR1P至2019-nCoV-HR2P(图1h)。2019-nCoV-HR1P/EK1复合物也显示出高螺旋度(77.9%)(图1i)。EK1还表现出与0.19μM的IC50的有效融合抑制活性(图1g)。综上所述,这些结果表明2019-nCoV S-HR1区域也是开发有效CoV融合/进入抑制剂的一个有希望的保守靶点。
进一步,我们评估了2019-nCoV-HR2P或EK1对表达ACE2的293T细胞中2019-nCoV-HR2P或EK1的抑制作用。如图1j所示,2019-nCoV-HR2P和EK1肽均能以剂量依赖方式显著抑制2019-nCoV假病毒感染,IC50值分别为0.98和2.38μM。
因此,我们共同确认2019-nCoV S-HR1和S-HR2在介导2019-nCoV与宿主细胞融合和进入宿主细胞中起关键作用。2019-nCoV可能具有与SARS-CoV相似的膜融合机制。当S1蛋白在人细胞上识别其受体时,HR1和HR2结构域相互作用,形成6-HB介导病毒与靶细胞的膜融合(图1k)。值得注意的是,2019-nCoV-HR2P和EK1(pan-CoV融合抑制剂)对S介导的细胞-细胞融合和2019-nCoV假病毒感染均表现出强大的抑制活性,表明2019-nCoV-HR2P或EK1肽在鼻喷雾剂和吸入制剂中的潜在发展,防治2019-nCoV感染。
翻译自Shuai Xia, Yun Zhu, Meiqin Liu, Qiaoshuai Lan, Wei Xu, Yanling Wu, Tianlei Ying, Shuwen Liu, Zhengli Shi, Shibo Jiang & Lu Lu . Fusion mechanism of 2019-nCoV and fusion inhibitors targeting HR1 domain in spike protein. Cellular & Molecular Immunology 。
常州大学医疗保健中心