翻译3:腺病毒载体COVID-19疫苗对恒河猴SARS-COV-2攻击的保护作用
发布时间: 2020-10-14 访问次数: 99
摘要
冠状病毒SARS-CoV-2的迅速传播极大地威胁着全球公共卫生,但目前尚无预防性疫苗。在这里,我们报告了一种复制能力不强的重组腺病毒血清型5 Ad5-S-nb2,它携带一个编码棘蛋白的密码子优化的基因。在小鼠和恒河猴中,肌肉注射Ad5-S-nb2可引起系统S-特异性抗体和细胞介导免疫(CMI)反应。鼻内接种可引起全身抗体和肺抗体反应,但CMI反应较弱。在肌肉内或鼻腔接种Ad5-S-nb2疫苗后30天,猕猴可免受SARS-CoV-2的攻击。随后的一项挑战显示,接种了10倍疫苗剂量(1 × 1010病毒颗粒)的猕猴也得到了保护,这证明了Ad5-S-nb2的有效性以及在较短时间内提供更多疫苗剂量的可能性。因此,Ad5-S-nb2是一种很有前途的候选疫苗,值得进一步的临床评价。
简介
由新出现的冠状病毒SARS-CoV-2引起的2019年冠状病毒病(COVID-19)迅速席卷全球。截至2020年7月22日,实验室确诊的COVID-19患者超过1400万,死亡人数近612000人。世界卫生组织宣布COVID-19为国际关注的突发公共卫生事件。COVID-19的常见症状是发热、咳嗽、淋巴细胞减少和胸部x线异常。从COVID-19患者中有一部分会持续释放病毒,而无症状携带者也可能传播SARS-CoV-2,这表明有持续和长期大流行的风险。目前还没有高效的抗病毒药物,急需一种有效的疫苗。
SARS-CoV-2是一种包被的单链正义RNA病毒,属于冠状病毒科和冠状病毒β属。SARS-CoV-2的基因组编码一个大的棘突蛋白,在病毒粘附和进入宿主细胞过程中起着关键作用。与其他冠状病毒一样,S蛋白可以被宿主蛋白酶切割成S1和S2亚基。S1亚单位包含受体结合域(RBD),病毒通过它与血管紧张素转换酶2受体(ACE2)结合。S2亚单位包含融合肽并促进膜融合和病毒进入。在最近的研究中,S蛋白常被认为是人类冠状病毒疫苗(如SARS-CoV、MERS-CoV和SARS-CoV-2)的主要抗原靶点,因为它含有中和抗体的主要表位。靶向RBD的中和抗体可阻断病毒与宿主细胞的结合,而靶向S2亚单位的中和抗体可抑制膜融合和病毒进入。
在这项研究中,我们产生了一个复制不全的重组腺病毒血清型5,它携带一个密码子优化的基因编码全长SARS-CoV-2s蛋白(Ad5-S-nb2)。我们研究了Ad5-S-nb2通过注射和非注射途径诱导小鼠和恒河猴的抗体和细胞介导免疫(CMI)反应。我们通过气管内攻击SARS-CoV-2评估候选疫苗对恒河猴的保护效果。
结果
Ad5-S-nb2的制备与表征
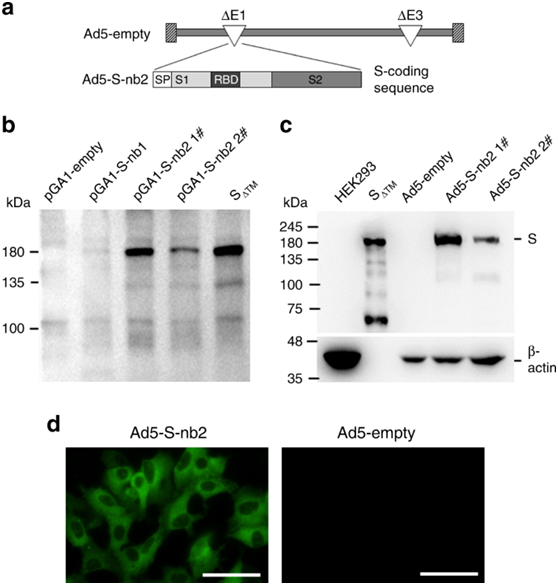
为了开发一种预防性的SARS-CoV-2疫苗,我们构建了一种复制不全的重组腺病毒Ad5-S-nb2,它能在感染细胞中高效表达SARS-CoV-2s蛋白(图1a)。通过改变密码子的用法来优化S编码序列,以增加其在人类细胞中的表达。与最初的病毒S编码序列相比,转染携带优化S编码序列S-nb2的质粒可显著提高人类细胞中S蛋白的表达(图1b)。我们将含有人巨细胞病毒启动子和S-nb2的表达盒插入到E1和E3缺失的Ad5载体的E1区。Ad5-S-nb2在人胚肾(HEK)293细胞中获得成功的挽救和增殖,为Ad5-S-nb2的复制提供了反式E1产物。在哺乳动物细胞如HEK293细胞和人肺癌A549细胞中感染Ad5-S-nb2导致S蛋白的有效表达(图1c,d)。Ad5-S-nb2诱导BALB/c小鼠产生抗体和CMI反应
为了评估Ad5-S-nb2的免疫原性,我们首先免疫了8周龄的雌性BALB/c小鼠。第1组和第2组通过肌肉注射(IM),每只小鼠接受1×109和5×109病毒颗粒(vp)。第4组和第5组通过鼻内滴注(图2a),每只小鼠接受1×109和5×109vp。第3组和第6组分别通过IM或IN-route接收5 × 109 vp Ad5空载体作为对照(图2a)。接种5 × 109 vp Ad5-S-nb2的IM注射液在接种后的第6天就对S蛋白、RBD和S2亚基产生显著的血清IgG反应,而1*109 vp Ad5-S-nb2对S蛋白、RBD和S2亚基的血清IgG滴度较低,显示出剂量依赖性反应(补充图1a)。血清对S蛋白、RBD和S2亚单位的IgG反应持续增加,直到第28天处死小鼠进行分析(补充图1a)。接种后第28天,接种5*109 vp Ad5-S-nb2的小鼠的血清抗S蛋白、RBD和S2亚单位的IgG滴度显著高于接种1*109 vp Ad5-S-nb2的小鼠(图2b)。接种Ad5-S-nb2后,在接种后第11天,对S蛋白、RBD和S2亚基的血清IgG反应水平较低(补充图1b)。在接种后28天,血清对S蛋白、RBD和S2亚单位的IgG反应增加到与IM免疫小鼠相似的水平。接种5*109 vp的小鼠的抗体效价高于1*109 vp的小鼠,显示出剂量依赖性效应(图2d)。此外,在支气管肺泡灌洗液(BALFs)中,接种Ad5-S-nb2引起S-特异性IgA反应(图2e),而IM注射在BALFs中没有引起显著的S-特异性IgA反应(图2b)。因此,注射Ad5-S-nb2可诱导小鼠全身IgG而非肺IgA转S蛋白,而IN接种可诱导小鼠全身IgG和肺IgA转S蛋白。
我们用SARS-CoV-2s蛋白假分型慢病毒检测小鼠血清和BALFs的中和活性。与S结合抗体反应一致,注射5*109 vp Ad5-S-nb2引起的血清中和抗体反应高于1 109 vp(图2f)。接种5*109 vp Ad5-S-nb2也比1*109 vp产生更高的血清中和抗体反应(图2f)。值得注意的是,接种剂量依赖性地诱导BALFs中和抗体反应,而含有Ad5-S-nb2的IM注射在BALFs中没有引起显著的中和抗体反应(图2g)。因此,免疫接种能诱导小鼠肺器官产生明显的中和抗体。
为了确定Ad5-S-nb2是否也能引起小鼠的细胞介导免疫(CMI)反应,我们用从小鼠脾脏分离的淋巴细胞进行了干扰素-γ(IFN-γ)酶联免疫斑点(ELISpot)试验。合成了覆盖S蛋白的20个氨基酸重叠肽,并将其分为S1和S2两个库。注射5 * 109 vp Ad5-S-nb2可在S1区诱导大量斑点形成细胞(SFCs),但对S2区的反应则少得多。5 *109 vp Ad5-S-nb2诱导的CMI反应高于1*109 vp(图2h)。然而,在小鼠中,接种Ad5-S-nb2诱导的系统性CMI反应远远低于IM疫苗(图2i)。
Ad5-S-nb2诱导NHPs抗体和CMI反应
接下来我们评估了Ad5-S-nb2在非人灵长类动物(NHPs)中的免疫原性。将成年中国恒河猴(macacamulatta)分为5组:(1)高剂量注射1 × 1011vp Ad5-S-nb2(n = 4);(2) 口服1*1011vp Ad5-S-nb2(n = 4),半剂量口服(我们后来在另一项研究中发现,口服接种对诱发猕猴免疫反应的影响微乎其微,因此我们后来一般将这一组称为5*1010vp Ad5-S-nb2疫苗);(3) 低剂量1 × 1010vp Ad5-S-nb2(n = 4);(4)1 *1011vp Ad5空白的IM注射液作为对照组(n 2);和(5)未接种疫苗的猕猴也被用作对照组(n 6)(图3a)。接种疫苗的猕猴年龄为6至14岁,相当于人类18至42岁17岁。在其他研究中,这些猕猴曾用流感病毒H1N1、H5N6、H7N7、H7N9和腺病毒血清型2载体埃博拉疫苗免疫(补充表1)。因此,这些猕猴可能更像人类,他们对各种病原体都有免疫力。
接种后第12天,接种1 × 1011vp Ad5-S-nb2的4只猕猴中有4只检测到明显的血清S-特异性IgG,4只接种1×1010VP的猕猴中有3只检测到血清S-特异性IgG。在接种疫苗的猕猴中,四分之三的猕猴也能检测到血清S-特异性IgG(图3b)。第24天,所有接种的猕猴血清S-特异性IgG均能检测到。高剂量免疫猕猴的IgG滴度似乎更高。在接受低剂量或高剂量免疫接种的猕猴中,S-特异性IgG继续增加。相比之下,接种疫苗的猕猴的S-特异性IgG滴度在第18天之后保持不变。接种疫苗的猕猴的血清IgG滴度比免疫接种的猕猴低1-2个对数。评估血清IgG对S蛋白不同区域的反应表明,IgG抗体针对整个S蛋白,包括RBD和S2区域(图3c)。
为了确定候选疫苗Ad5-S-nb2是否也能在NHPs中引起CMI反应,我们检测了外周血单个核细胞(PBMCs)中S-特异性IFN-γ-分泌细胞对S1和S2肽库的反应。在接种疫苗后的第18天,8只免疫接种的猕猴中有8只对S1肽库有CMI反应,而8只中有6只对S2肽库有CMI反应(图3d)。在接种疫苗的猕猴中,只有2/4对S1肽库有系统的CMI反应,而这些猕猴中没有一只对S2肽有CMI反应。因此,在恒河猴中,CMI反应主要针对S1区,与在小鼠中观察到的情况类似。这一结果表明,IM疫苗可引起系统性CMI对S蛋白的反应,尤其是S1区,而IM疫苗引起的系统CMI反应较弱。
Ad5-S-nb2对NHPs患者SARS-CoV-2攻击的保护作用
为了评估接种Ad5-S-nb2是否能预防SARS-CoV-2感染,在接种后30天,我们用2*104 50%组织培养感染剂量(TCID50)的气管内接种SARS-CoV-2(菌株2019-nCoV-WIV04)(图4)。由于生物安全4级实验室的空间限制,随机选择3只高剂量免疫接种猕猴和3只在接种中的猕猴进行挑战(图3a)。四只未接种疫苗的猕猴也被注射了相同剂量的SARS-CoV-2(图3a)。激发后,所有未接种疫苗的猕猴在咽部拭子中至少有10天或整个实验期间有病毒脱落(图4a)。猕猴C1在第2天至第6天的病毒载量峰值为2.2×106拷贝ml−1,第10天甚至有3.7×104拷贝ml−1。猕猴C2在第2天有1.1×104个拷贝ml-1,第10天有6000个拷贝ml-1。猕猴C3在安乐死前第5天的峰值病毒载量为4.2×106拷贝ml-1,第7天为2800拷贝ml-1。猕猴C4有一个延迟的病毒释放,这似乎是阳性的第10天(图4a)。另外,两只猕猴(D1和D2)被SARS-CoV-2的400tcid50攻击并作为对照组。猕猴D1在整个研究过程中都有病毒脱落,第6天的峰值病毒载量为2.0*105 copies ml−1,在第10天有约1.0*104 copies ml−1。猕猴D2在整个研究过程中都有病毒脱落,第5天的峰值病毒载量为1.5×106拷贝ml−1,第10天为570拷贝ml−1。
在第5天之前,高剂量免疫接种的猕猴在咽拭子中没有可检测到的病毒基因组或略高于检测限,然后在第7天之后变得无法检测(图4b)。100109号猕猴只在第5天出现病毒性斑点(480份ml-1),之后就无法检测到。116004号猕猴和116008号猕猴在第1天(分别为360和770个拷贝ml-1)和第5天(350和250个拷贝ml-1)出现病毒性斑点,之后就无法检测到(图4b)。因此,接种1 × 1011vpad5-S-nb2的IM疫苗可有效预防SARS-CoV-2感染。有趣的是,接种疫苗的猕猴在激发后的前4天内没有发现病毒。134018号和140052号猕猴在第6天或第7天有一个小的病毒性水泡(约1000份ml−1),之后就无法检测到。110113号猕猴在第6天左右出现病毒性水泡(7800份ml-1),但在第7天下降,在第10天变得无法检测(图4c)。因此,虽然免疫诱导的系统抗体和CMI反应比IM疫苗低得多,但IN疫苗接种能有效预防SARS-CoV-2感染。
鉴于高剂量IM疫苗具有有效的保护作用,我们随后在IM疫苗接种后8周用低10倍的剂量(1 × 1010vp)对3只猕猴进行攻击。再次,所有三只猕猴都能有效地抵御气管内SARS-CoV-2的攻击(图4d)。编号063585和080066的猕猴在第5天有一个小的病毒斑点(410和590拷贝ml-1),但在第7天几乎无法检测到。134056号猕猴在第3天有一个小的病毒性斑点(490份ml-1),之后就无法检测到。
我们在所有接种疫苗的猕猴中均未发现抗体依赖性感染增强(ADE)的迹象。在猕猴咽拭子中接种疫苗的猕猴与未接种病毒的猕猴进行比较。接种疫苗的猕猴的峰值病毒载量为2.9±0.4 log10 copies ml−1,而未接种疫苗的猕猴的峰值病毒载量为5.2± 1.5 log10 copies ml−1(补充图2)。到第10天或安乐死时,所有未接种疫苗的猕猴咽拭子中的病毒脱落呈阳性,而所有接种疫苗的猕猴的病毒脱落均为阴性。因为病毒载量的峰值并不反映总病毒随时间的推移而存在的情况,我们接下来根据曲线下面积(AUC)计算病毒载量。接种疫苗的猕猴的病毒AUC为2.7±0.6 log10,比未接种疫苗的猕猴的病毒AUC 6.1±1.0 log10低2500倍(图4e)。最重要的是,我们评估了在猕猴被安乐死后从9个解剖位置采集的活检样本中是否存在病毒基因组,包括气管、左右支气管、左肺和右肺的上、中、下部位(图5a)。在第7天,在未接种疫苗的猕猴C3的气管(5.7×105拷贝ml−1)、左支气管(2.4×105拷贝ml−1)和左肺下部(1.8×104拷贝ml−1)中检测到病毒基因组。在第10天,未接种疫苗的猕猴C4的气管(4.7××104拷贝ml−1)、左支气管(2.2××104拷贝ml−1)和右支气管(1.8××104拷贝ml−1)中也检测到病毒基因组。相比之下,在第7天(4只)或第10天(5只)从9只接种过疫苗的猕猴身上采集的81份活检样本中均未检测到病毒基因组。我们对未接种疫苗和接种疫苗的猕猴的肺切片进行了组织病理学分析(图5b-f)。在未接种疫苗的猕猴中,气管内接种SARS-CoV-2可引起严重的间质性肺炎,表现为肺泡间隔扩张,大多数肺泡内单核细胞和淋巴细胞浸润,以及一定比例的肺泡水肿(图5b)。在接种疫苗的猕猴中,激发没有导致一些猕猴出现明显的病理异常或轻微的组织病理学变化,这可能是由直接将SARS-CoV-2注入肺部引起的(图5d-f)。
中和试验前与中和试验后血清抗体效价比较。所有未接种疫苗的猕猴在激发前或激发后7天均未表现出抗SARS-CoV-2的血清中和活性(<1:50)(图4f)。免疫后30天激发前,3只高剂量免疫接种猕猴血清中和抗体滴度分别为1:636、1:389和1:784,分别为100109、116004和116008。激发后第7天,第100109号、第116004号和第116008号猕猴的中和抗体滴度分别在1:1225、1:518和1:1350时轻微增加(不到2倍),表明激发没有或弱的增强作用(图4g)。三只接种疫苗的猕猴在激发前血清中和抗体滴度较低(IC50:1:164、1:137和1:150),在激发后第7天没有显著变化(分别为IC50:1:193、1:168和1:130)(图4h)。在接种8周后,对三只低剂量免疫接种的猕猴进行攻击,只有一只(编号080066)的血清中和抗体滴度显著升高(IC50:1:188至1:1460),而另外两只猕猴血清中和抗体滴度没有升高(IC50:1:315至1:192,挑战后第7天1:400至1:330,编号063585和编号134056(图4i)。结果表明,接种该病毒后,猕猴对该病毒的免疫反应可能立即被消除。
我们还检测了接种疫苗的猕猴体内抗Ad5中和抗体的水平。免疫后,免疫后的猕猴血清Ad5中和抗体效价迅速升高。有趣的是,接种疫苗的猕猴抗Ad5中和抗体的出现至少延迟了6天,血清Ad5中和抗体反应比免疫接种的猕猴低10倍左右(补充图3),这表明在路线上可以为重复接种腺病毒载体疫苗提供优势。
讨论
本研究表明,候选疫苗Ad5-S-nb2能在啮齿动物和NHPs中诱导S特异性抗体和CMI反应。单次注射低剂量1 × 1010vp Ad5-S-nb2可有效保护老年恒河猴抗SAR-CoV-2攻击。非注射疫苗接种途径,如接种疫苗,也能提供充分的保护。候选疫苗Ad5-S-nb2提供了快速有效的病毒学控制,在激发后第7天和第10天收集的所有9个解剖样本中,没有从每只接种的猕猴身上检测到病毒基因组。
本文综述了近年来国内外针对SARS-18疫苗和猕猴疫苗的研究进展。大多数候选疫苗需要多次注射。灭活的全病毒疫苗在第三次接种后一周内需要三次注射(加明矾佐剂)以获得部分保护(中等剂量,3 3 3 3 3 3 6 g)或有效保护(高剂量,3 6 g)。然而,在挑战者18日后第7天接种中等剂量(3 × 3 3 g)疫苗的猕猴肺活检标本中可以检测到病毒基因组。表达全长S蛋白的DNA疫苗也需要两次注射来减少病毒的复制和脱落,但没有达到杀菌保护。一种Ad5载体COVID-19疫苗在一期临床试验中显示出良好的免疫原性,但在动物模型中的接种和挑战性研究尚未报道。值得注意的是,所有报告的挑战性研究都是在最后一次疫苗接种后的1到3周内完成的,当时抗体反应是最高的,而且没有关于保护性免疫寿命的报告。我们的挑战性研究是在单剂疫苗接种后1个月甚至近2个月进行的。有趣的是,大多数接种疫苗的猕猴在激发后第7天的中和抗体滴度没有增加。这一观察结果不同于DNA疫苗和灭活全病毒疫苗,它们在激发后第7天表现出记忆性免疫反应,中和抗体滴度显著增加,表明接种病毒具有增强作用,并且在挑战后可能出现病毒复制。在我们的研究中,有效地消除了疫苗接种后病毒复制的可能性。与全病毒灭活疫苗只引起抗体反应不同,腺病毒载体疫苗也能引起CMI反应,这可能通过消除病毒感染细胞提供额外的保护机制。此外,免疫接种在呼吸系统中提供粘膜免疫,可有效地立即消灭进入鼻孔和呼吸道的病毒。
在过去的时间,人们对其他人类冠状病毒SARS-CoV和MERS-CoV的疫苗接种方法进行了探索。尽管MERS-CoV疫苗已在动物模型中显示出保护作用,但据报道,一种基于编码S蛋白的改良痘苗病毒-安卡拉载体的SARS-CoV疫苗可引起ADE疾病。不充分的Th1偏向性T细胞反应也可能导致SARS-CoV感染的免疫病理学。在我们的研究中,没有观察到ADE的迹象,这表明Ad5-S-nb2诱导的免疫反应并不能增强SARS-CoV-2的感染或致病性。在未观察SARS-2和SARS-2的原始免疫应答的情况下,观察到SARS-2和SARS-18对恒河猴的免疫应答均有效。
重组Ad5载体疫苗的安全性已在各种临床试验中得到证实。最近,一种Ad5载体的COVID-19疫苗被报道在接种后24小时内会引起注射部位疼痛、发热和疲劳,但没有出现严重的不良反应。在该临床试验中,使用了5×1010~1.5×1011vpad5载体COVID-19疫苗,高于NHP实验中使用的低剂量方案(1×1010vp)。Ad5-S-nb2的强大效价可能使低剂量诱导保护性免疫,从而减少疫苗相关的副作用。我们建议Ad5-S-nb2作为控制SARS-CoV-2大流行的预防性疫苗,值得进一步的临床评估。我们的研究还表明,非注射途径,如给药,有很大的潜力提供有效的保护,容易接种。免疫接种旨在刺激呼吸道和可能的胃肠道粘膜免疫。虽然在我们的挑战模型中直接气管内接种SARS-COV-2绕过了鼻腔和咽部屏障,破坏了保护作用,但在接种Ad5-S-nb2时仍显示出了很好的保护作用。在Ad5载体埃博拉病毒疫苗中,粘膜接种途径也被证明可诱导全身免疫和粘膜免疫。黏膜免疫对于诸如SARS-CoV-2这样的呼吸道病毒疫苗是很重要的。目前,对SARS-CoV-2的免疫保护相关因素知之甚少。与S蛋白结合的血清抗体和中和抗体主要用于评估恢复期血浆疗法和疫苗。然而,我们发现,与IM疫苗相比,免疫诱导的系统免疫应答相对较低,但仍能有效地抵御SARS-CoV-2。这一结果意味着血清抗体滴度不一定能预测保护效果。局部免疫反应,即气道黏膜S-特异性抗体和T细胞免疫在阻断SARS-CoV-2感染中起着重要作用。
Ad5在人类中的流行可能会降低Ad5载体疫苗的效力,这是因为自然暴露或先前接种的抗载体免疫已经存在。据报道,在人群中预先存在的Ad5中和抗体在美国为40%-69%,在中国南部为77%,在非洲为80%。最近的一项Ad5载体COVID-19疫苗临床试验表明,高水平的Ad5中和抗体会影响疫苗接受者中抗SARS-CoV-2中和抗体的血清转化。高剂量疫苗(1.5×1011vp)比低剂量(5×1010vp)的血清转化率高。虽然先前存在的Ad5免疫可使接种的Ad5载体疫苗的一部分失活,但增加剂量或使用更有效的方法来递送Ad5载体疫苗可绕过先前存在的Ad5免疫,从而获得足够的抗原特异性免疫应答。据报道,腺病毒载体疫苗的鼻腔输送受先前存在的Ad5抗体的影响较小。Ad5载体埃博拉病毒疫苗需要相对高剂量的IM注射,以在抗Ad5抗体血清阳性的个体中产生显著的中和抗体,而在NHPs中,通过气道输送Ad5载体疫苗规避了先前存在的抗载体免疫并诱导了针对埃博拉病毒感染的保护性免疫反应。在本研究中,我们发现接种后的猕猴血清中抗Ad5中和抗体反应比免疫接种的猕猴有延迟增加和降低的趋势,提示在接种Ad5载体疫苗时,抗腺病毒免疫的影响较小。此外,通过鼻孔接种Ad5载体疫苗可能使自我免疫成为可能,从而减轻医护人员的负担,使更多人能够在短时间内接种疫苗。综上所述,我们的研究表明,开发一种安全有效的疫苗来控制SARS-CoV-2感染和预防COVID-19是可能的。Ad5-S-nb2是一种候选疫苗,值得在人类身上进一步评估。
方法
腺病毒载体疫苗
复制不全重组腺病毒Ad5-S-nb2构建如下。总之,我们合成了SARS-CoV-2s蛋白(GeneBank ID:43740568)的原始(称为S-nb1)和密码子优化的(称为S-nb2)编码序列(Genescript,China)。用PCR扩增S-nb1和S-nb2,分别插入穿梭质粒pGA1中,得到pGA1-S-nb1和pGA1-S-nb2。用于S-nb1的引物组包括前引物(nb1-F:5′-GCGTTTAACTTAAGCTGGTACGAGCTCGATCCGCCACTGTTTGTT TTTCGT-3′)和反向引物(nb1-R:5′-AgataGGGCCCTCTAGA CTAGTTTTGT-3′)。用于S-nb2的引物组包括正向引物(nb2-F:5′-GCGTTTAACTTAAGCTGGTACCAGTCGGATC CGCCACATGTCGTTCGTTTCTGGT-3′)和反向引物(nb2-R:5′-AGAGATCCTCTAGACTAGTTTAGCTGTGTGTGTCGTC-3′)。将pGA1-S-nb2线性化并与大肠杆菌BJ5183活性细胞(thermofisher)中的E1和E3缺失的pAd5ΔE1ΔE3主链进行同源重组。将所得pAd5-S-nb2线性化并转染到HEK293细胞(ATCC®CRL-1573™) 抢救Ad5-S-nb2。最后,将Ad5-S-nb2和空的Ad5载体Ad5-empty进行繁殖,通过氯化铯密度梯度离心纯化,滴定,并储存在−80°C下。
SARS-CoV-2库存
SARS-CoV-2菌株2019-nCoV-WIV04是从中国武汉的一名COVID-19患者中分离出来的(GISAID,检索号:EPIüu ISL_402124)。在Vero E6细胞(ATCC®CRL–1586)中繁殖SARS-CoV-2种子™),保存在Dulbecco改良的Eagle's培养基(DMEM,Thermo Fisher)中,添加10%胎牛血清(FBS)、1 mM L-谷氨酰胺、100 IU-ml−1青霉素和100 ml−1链霉素。在感染后72小时,收集培养上清,用标准50%组织培养感染剂量(TCID50)测定病毒滴度。
酶联免疫吸附试验
ELISA法检测免疫血清中结合IgG抗体。用0.05μg全长S蛋白,S2或RBD(中国生物公司)在4℃过夜,在室温下用1 μg全长S蛋白、S2或RBD(中国)进行封闭,并在室温下用0.05%吐温-20(PBST)和2%牛血清白蛋白(BSA)封闭2小时。血清和BALF样品被连续稀释并添加到每个孔中。在37℃孵育30分钟后,将辣根过氧化物酶(HRP)结合的山羊抗小鼠(1:2000加入含5%脱脂牛奶的PBS中;Beyotime Biotechnology,中国)或山羊抗猴IgG抗体(含5%脱脂牛奶的PBS中1:2000;Abcam)。在室温下孵育30分钟后,用3,3',5,5'-四甲基联苯胺(TMB)底物进行反应,并在450 nm下测定。截止值计算为未接种疫苗动物血清中450 nm(OD450) + 3 nm(OD450)。终点滴度计算为最高血清稀释度的倒数,此时OD450值等于或大于临界值。用HRP结合的多克隆山羊抗小鼠IgA抗体(含5%脱脂牛奶的PBS中的1:2000;Abcam)同样测量小鼠BALF中的IgA抗体。
酶联免疫斑点
用新鲜分离的小鼠脾淋巴细胞或猕猴PBMCs进行IFN-γELISpot检测。简言之,将96孔无菌微滴度板(默克密理博)在4℃下涂以小鼠或猴IFN-γ包衣抗体(U-CyTech)过夜。用密度梯度培养基(加拿大淋巴组织)分离小鼠脾淋巴细胞或猕猴PBMCs,以每孔4 × 105个细胞接种在平板中,然后用与S1区和S2区相对应的两个肽库(Genescript,中国)以每肽2 ml−1的速度刺激。培养24小时后,用生物素化检测抗体(U-CyTech)和碱性磷酸酶结合链霉亲和素(U-CyTech)和NBT/BCIP试剂(Pierce)进行培养。最后,用ELISpot阅读器(Bioreader 4000,BIOSYS,德国)对斑点进行计数。
免疫荧光分析
A549电池(ATCC®CCL-185™) 感染Ad5-S-nb2或Ad5空,每细胞0.2tcid50。感染后24小时,用4%多聚甲醛固定细胞。用含5%BSA的1×PBS封闭细胞后,用兔抗S蛋白单克隆抗体(含4%BSA的PBST中的1:100;中国生物)标记细胞,然后用Alexa-Fluor 488结合山羊抗兔二级抗体(含4%BSA的PBST中的1:200;Yeasen Biotech,China)标记。最后,在荧光显微镜下观察细胞。
SARS-CoV-2的微量中和试验
用ABSL-4中的PRNT检测了Ad5-S-nb2免疫恒河猴的中和抗体。简而言之,血清样本在56℃下热灭活90分钟,并从1:50到1:12150连续稀释三倍。将等量的病毒储备与稀释血清混合,并在37℃下孵育1小时。随后,将100μl混合物添加到12孔平板中的单层Vero细胞上,培养1小时。然后用补充有2%胎牛血清(FBS)和0.9%甲基纤维素的DMEM代替感染性混合物。3天后,细胞用4%甲醛固定30分钟,最后用自来水冲洗,结晶紫染色。中和效价计算为血清稀释液,在该稀释液中,斑块比纯病毒孔减少50%。
疫苗接种实验已获得机构动物护理和使用委员会的批准(分别为小鼠和猕猴的编号为2020025和2020009)
基于假型慢病毒的中和试验
简言之,将表达SARS-CoV-2s蛋白的质粒、携带萤火虫荧光素酶表达盒的慢病毒载体主链和包装质粒共转染293t细胞,制备了S蛋白假定型慢病毒载体。将免疫血清和BALF连续稀释并与假型病毒在37℃下孵育1小时。随后,将混合物添加到293 T细胞(ATCC®CRL-3216™) 在96孔板中稳定表达人ACE2的衍生细胞系。在感染后48小时,检测细胞裂解液中的荧光素酶活性。中和效价计算为血清稀释液或BALF稀释液,此时荧光素酶活性降低至仅病毒孔的50%。
腺病毒中和试验
免疫前后猕猴血清中抗Ad5载体的中和抗体测定如下。简而言之,将HEK293细胞接种到96孔板中。一天后,连续稀释的猕猴血清在56℃下失活90分钟,并以每孔4 106vp与表达Ad5 SEAP的分泌性碱性磷酸酶孵育。然后将混合物添加到96孔板中,并在37℃下培养24小时。最后,收集上清液,并根据制造商的说明使用磷酸光系统(Thermo Fisher)检测SEAP活性。记录相对光单位(RLU),并计算滴度作为抑制50%RLU值的稀释液。
qRT-PCR
用一步法实时定量RT-PCR定量检测咽标本或组织匀浆中的病毒RNA。将拭子置于1 ml DMEM中。用QIAamp病毒RNA迷你试剂盒(Qiagen)提取病毒RNA。RNA在50μl洗脱缓冲液中洗脱,作为RT-PCR的模板。引物组包括正向引物(RBD-qF1:5′-CAATGGTTAAGGCAGG-3′)和反向引物(RBD-qR1:5′-CTCAAGTCTGTGATCACG-3′)。根据制造商的说明,使用HiScript®II One-Step qRT PCR SYBR®Green Kit(Vazyme Biotech Co.,Ltd.)使用2μl RNA定量病毒RNA拷贝。扩增程序设置如下:50°C持续3分钟,95°C持续30°s,然后40个循环,包括95°C持续10°s,60°C持续30°s,以及ABI stepone机器中的默认熔化曲线步骤。标准曲线是用体外转录产生的SARS-CoV-2rna片段的连续稀释生成的。检测限由标准曲线和稀释度确定,约为每毫升拭子洗脱液200份或每克活检样本约1000份。病毒载量计算为1 ml拭子洗脱液或1 g组织中SARS-CoV-2的基因组拷贝数。曲线下面积是使用Graphpad Prism 7.0版计算的。
免疫印迹分析
将pGA1-NB1(4μg/孔)、pGA1-NB2(4μg/孔)、pGA1-NB2(4μg/孔)或pGA1空(4μg/孔)转染HEK293细胞,或以0.2或0.05tcid50转染HEK293细胞。转染或感染后24小时,取细胞,用裂解缓冲液处理,进行SDS-PAGE。转移后,用兔抗SARS-CoV-2s蛋白单克隆抗体(Sino-biologic,China)孵育细胞膜,然后用HRP结合的山羊抗兔二级抗体(SeraCare Life Sciences)孵育。最后,用化学发光HRP底物(Merck)制备了膜。同时检测β-肌动蛋白的表达作为内部对照。
量化和统计分析
所有的定量分析都是无盲法的。统计参数包括n的定义和精确值(例如,动物总数和重复次数)、偏差、p值以及统计检验的类型,均在图和相应的图例中报告。使用GraphPad Prism 7.0版(GraphPad软件)对病毒学和免疫学数据进行分析。组间比较采用不配对的学生t检验(双尾)。采用配对t检验(单尾)对同一组不同时间点进行比较。当p值小于0.05时,差异被认为具有统计学意义。数据图是使用GraphPad Prism版本7构建的。图和插图是使用Photoshop版本CS5(Adobe Systems Inc.)和Microsoft Powerpoint 2010版(Microsoft)创建的。
报告摘要
有关研究设计的更多信息,请参阅与本文相关的自然研究报告摘要。
Liqiang Feng, Qian Wang, Ling Chen. An adenovirus-vectored COVID-19 vaccine confers protection from SARS-COV-2 challenge in rhesus macaques Nature Communications 11,: 4207 (2020)
常州大学医疗保健中心